摘要
重组蛋白的亲和纯化通常是将重组蛋白克隆到含有对固定化树脂具有高度特异性的融合蛋白或肽标记的表达载体中。在许多情况下,融合蛋白或肽也会增加重组蛋白的溶解性,降低对宿主细菌细胞的毒性。但带有亲和标签的重组蛋白也面临一些问题,比如标签有时会对目的蛋白的结构甚至生物活性产生消极影响,这就需要对标签进行去除。在通过亲和力分离纯化目的蛋白后,如果标签的存在将显著影响其生物功能或适用该蛋白的安全性,则需要能够移除这些标签,并且这一操作通常是有必要的。许多策略被设计用来在纯化后去除标签。
在本文中,我们将总结使用亲和标记去除策略,并讨论蛋白质纯化系统的未来方向。
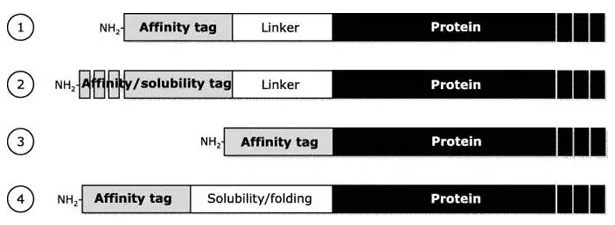
亲和表达及酶切策略【1】
1. 融合表达一个亲和标签及用于纯化后酶切的酶切位点linker
2. 亲和标签既是纯化标签同时也促进目的蛋白的可溶性表达
3. 用于外切酶( TAGZyme)在纯化后从N端切除亲和纯化标签
4. 部分促进可溶性表达的序列不带有亲和标签,例如Trx,因此需要额外加上亲和标签
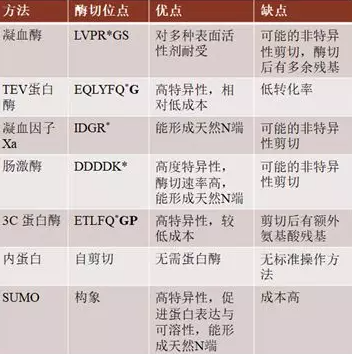
常用标签去除方法及其优缺点
凝血酶
这种37 kDa的丝氨酸蛋白酶被广泛使用,通过切割LVPR*GS的凝血酶识别序列,从靶蛋白中去除His-tag和其他标签。尽管凝血酶识别的序列是相对特异的,但有报道称,凝血酶的商业制备会导致非特异性酶切。凝血酶比其他蛋白酶的一个优点是,它能够在多种表面活性剂存在下保持高活性。因此,凝血酶可用于纯化膜蛋白。
TEV蛋白酶
TEV蛋白酶是在烟草蚀刻病毒中发现的一种酶的27kDa的C端催化亚单位。它对序列ENLYFQ*S.具有高度特异性。最初发现经过长时间的培养,该蛋白酶会自我消化。然而,通过对其进行各种突变修改,已可以作为去除标签的工具。研究发现,S219V突变使其蛋白水解酶活性增加了至少两倍,同时也降低了自身降解的敏感性。此外,缺乏C端238-242残基的蛋白酶变体具有更高的表达量和催化活性。TEV蛋白酶的主要缺点是与其他蛋白酶相比转化率较低。其较低的转化率可能解释了其对识别序列的高度特异性,但导致消化时间长和消化所需的蛋白酶量较高。然而一个优势是,识别序列中的丝氨酸可以转变成蛋氨酸,在酶切后能产生一个“天然”的N末端。由于TEV蛋白酶切位点的广泛性和低成本,也是大规模纯化中很好的选择。
3C蛋白酶
3C蛋白酶是一种来源于人鼻病毒的48kDa大小的重组半胱氨酸蛋白酶。与TEV蛋白酶一样,它对其识别序列LEVLFQ*GP具有高度特异性。3C蛋白酶也被设计成含有一个亲和标签,它有助于在裂解后将其从纯化蛋白溶液中去除。主要缺点是酶切后不能目的蛋白不能形成天然N末端。另一方面,与TEV蛋白酶相比,3C蛋白酶在4摄氏度下有10倍以上的活性。
内蛋白介导的自剪切
内蛋白在细菌和酵母菌中发现的能够自我切除的蛋白质,并且已经被改进成为能够在N末端或C末端进行剪切以达到目的蛋白标签去除的目的。例如来自结核分枝杆菌的微小内肽蛋白I-CM突变体已被设计成有利于C末端剪切。当pH值变成6时,C端到I-CM蛋白的序列将被剪切。如果将一个亲和标签融合在内蛋白的N端,目的蛋白在C端,则可在一定条件下实现无标签蛋白的纯化。该系统的优点是不需要使用蛋白酶来切割亲和标签。缺点是必须将蛋白分成两部分进行纯化,以便于纯化后的反式剪切,并且可能留有额外的氨基酸残基。此外在室温下完全剪切需要比蛋白酶剪切更长的时间。由于用于蛋白质纯化的内蛋白种类繁多,目前还没有一个可以应用于各种不同性质的蛋白质的标准或通用方案。
小泛素相关修饰剂(SUMO)
用于蛋白质纯化的最常见的SUMO蛋白酶是Ulp1,一种27kDa的酵母酶,能够将SUMO部分从靶蛋白中去除。与其他识别线性氨基酸序列的蛋白酶不同,SUMO蛋白酶识别其底物的三级结构,因此具有高度特异性。SUMO底物是一个通常在目的蛋白N端加入的用于提高其溶解性和表达的10kDa的蛋白,与MBP水平相当。与其他蛋白酶相比,它的一个主要优势是在2M尿素和高盐浓度的条件下依然具有较高的酶切活性。SUMO纯化系统是一个具有高溶解性、高位点酶切特异性、能产生天然N末端等优势的可靠的蛋白质表达与纯化平台。但缺点是成本相对较高。
结论
回顾过去几十年为表达和纯化重组蛋白而开发的亲和标签的发展趋势,为了提高纯化效率,已经向使用IMAC进行了重大转移。从2000年起,由于免疫亲和树脂的持续高成本以及其他纯化系统的改进,使用表位标签的研究已经大幅减少。但在需要载体蛋白促进适当折叠、增加溶解性和提高表达水平的应用中,这些标签的使用仍然是有价值的,有时是必要的。考虑到这一需要,在选择蛋白质纯化的亲和标签和去除标签的工具方面有了许多不同的方法。在过去15年中,载体蛋白与高亲和力结合的IMAC标签的结合使用有了越来越多的趋势。未来的趋势是使用与高可溶性载体蛋白的N端融合的小分子的亲和力标签,促进目的蛋白的折叠、溶解、表达和纯化,并进行柱上的纯化及酶切位点的去除。
参考文献
【1】C.Amarasinghe, J.P. Jin, The Use of Affinity Tags to Overcome Obstacles inRecombinant Protein Expression and Purification, Protein Peptide Lett, 22(2015) 885-892.
【2】J. Arnau, C. Lauritzen, G.E. Petersen, J. Pedersen,Current strategies for the use of affinity tags and tag removal for thepurification of recombinant proteins, Protein Expres Purif, 48 (2006) 1-13.



