建立蛋白质纯化工艺时,最重要的是需要考虑纯化得到的蛋白质应能满足其后续应用要求。蛋白质的数量及纯度都必须满足实验分析要求。而且,因为后续研究需要的是保持良好折叠结构的活性蛋白质,因此蛋白质行为的相关信息也需要考虑。在纯化及后续的保存过程中,很多处理方法都会对蛋白质的性质产生影响,如蛋白质的去折叠、聚集、降解和失活等。制定详细计划,在最短时间内完成蛋白质纯化,并在最稳定的条件下进行保存才算是成功地完成了其整个纯化过程。
缓冲液体系
每一步纯化过程中,蛋白质的溶液环境对其稳定性和活性的保持都非常关键。蛋白质应该保存在一个良好的缓冲液环境中,要避免突然的pH值变化,以其防止对蛋白质折叠状态、溶解性和活性造成不可逆的影响。
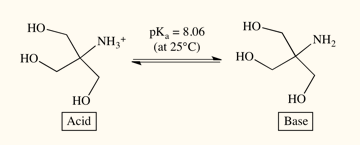
图 1. 含Tris碱及其酸式物的Tris缓冲液溶液。Tris 25°C的pKa值是8.06,表示当pH=8.06,50%的Tris是质子化(酸式结构),50%是去质子化(碱式结构)。
缓冲液是一种含有共轭酸/碱对的水溶液。缓冲液的pH值范围根据其pKa值决定。该pKa值定义为50%的分子为酸式结构,50%为碱式结构时的pH值 (图1)。关于缓冲液的一个常规原则是,其pH值应保证在pKa值左右1个pH值单位范围内,从而保证其具有良好的缓冲能力。如此可以保证同时有足够的以酸式结构和碱式结构存在的分子在加入 H+ 或者 OH- 时可以将它们中和。这样,缓冲液就可以防止pH变化导致的蛋白质稳定性改变。
一种好的缓冲液必须具有以下特征 :
水溶性
化学稳定性
在所需pH范围内良好的缓冲能力
与分析和实验应用条件具有良好的兼容性
与其他溶质具有良好的兼容性
很多物质都可以用于生物缓冲液。最常使用的缓冲液成分通常具有接近中性的pKa值,可在生理pH值范围左右使用。表1列出了4种最常用的生物缓冲液、各自的pH值应用范围及各自可能对蛋白质纯化过程产生影响的优缺点。为保证足够的缓冲能力,这些缓冲液的浓度通常为25mM。
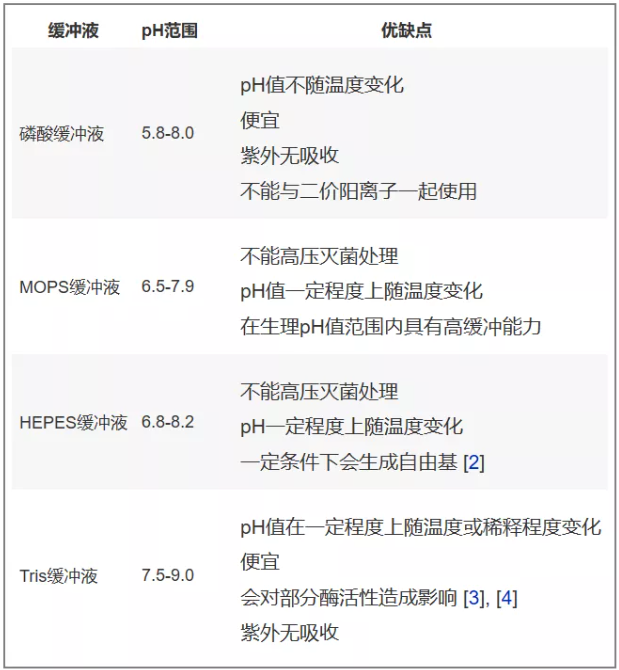
表一:蛋白质纯化中最常用的生物缓冲液。缓冲液在一定pH值范围内可保持它们的缓冲能力,部分缓冲液成分会对某些层析过程或者分析实验造成影响。
溶液添加剂
除了一个合适的缓冲液体系,蛋白质纯化过程中——从溶菌到保存——所使用的溶液通常还含有很多其他对蛋白质纯度、稳定性和活性方面均具有一定作用的成分。
溶菌缓冲液和纯化工艺的前期步骤中常常会添加蛋白酶抑制剂以防止目标蛋白质被内源性蛋白酶酶解。而纯化工艺的后期一般不用再添加这些蛋白酶抑制剂,因为此时几乎所有的蛋白酶都已经从目标蛋白质分离出去。蛋白质的保存缓冲液中通常要添加金属螯合剂,如EDTA或EGTA。这些金属螯合剂与 Mg2+结合以防止目标蛋白质被所含的金属蛋白酶分解。还有一些其他的添加剂,主要是用来保护蛋白质不被破坏和增强其溶解性。
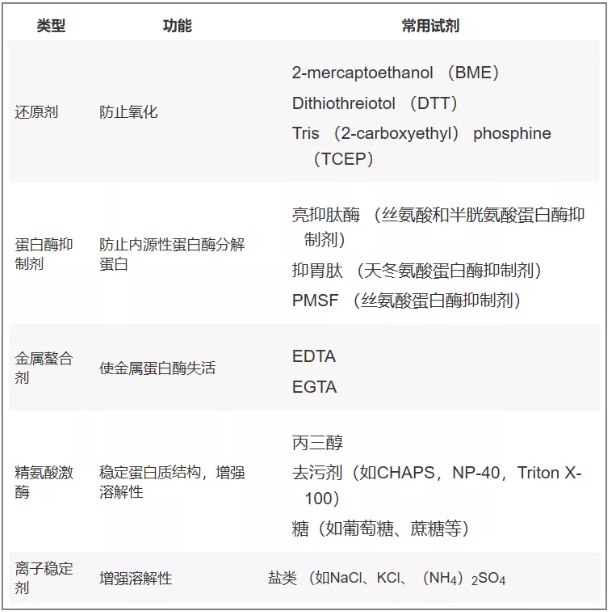
表二:蛋白质纯化中用于增强蛋白质稳定性的常用添加剂。
添加剂只在必要时才使用。可能需要多次尝试才能确定某些添加剂是否对一些特定蛋白质的纯化工艺有效。
表达系统的影响
开始纯化蛋白前应先制备初始样品。真正进行蛋白纯化的操作之前,首要考虑是目的蛋白的来源。样品来源可为原始样品,例如肝脏,肌肉或脑组织。虽然后基因组学领域的研究者很少使用原始组织纯化蛋白,但当研究者想要关联某一蛋白序列的催化活性时,会有这样的需求。
当前,更为常见的是从重组来源的样品纯化蛋白质。一些重要决定需要提前考虑以便优化后续的纯化。研究者需要考虑蛋白质的最终用途(例如酶测定,结构研究,抗体生成),因为这将决定最终蛋白质制备所需的量和纯度。尽管蛋白质表达的详细讨论超出本文范围,但是在这一点上仍有几个值得考虑的基本点,因为它们直接影响后续的蛋白纯化。
哪个系统的表达水平最高?一般规则是,表达水平越高,越容易获得大量高度纯化蛋白。
1.如果选择大肠杆菌表达系统,最终目的可溶性表达或不可溶表达是包涵体形式吗?由于包涵体中有高丰度的
重组蛋白,包涵体的分离本身构成了纯化的重要步骤; 这必须与溶解难易和随后包涵体中再折叠靶蛋白的难易以及可溶性蛋白的最终产量相平衡 。已经有许多工作优化了从包涵体中产生功能蛋白的产量 。
2.另一个考虑是是否靶向胞内或胞外(分泌的)表达。胞内表达需要将蛋白质从大量宿主细胞蛋白中纯化而来。相比之下,特别是当宿主细胞在无血清条件下生长时 ,目标蛋白的有效分泌要求蛋白必须从少量分泌的宿主蛋白中纯化而来。
无论目标蛋白的来源如何,作为纯化的初始步骤,原始样品的制备很重要。同时也需要考虑表达和纯化策略。
样品的制备
目标蛋白的胞外分泌可使用简单快速亲和纯化方案 ;所需的唯一样品制备可能需要倾倒贴壁细胞的条件培养基或者低速离心以去除悬浮细胞。当然,制备过程的第一步色谱层析时可能需要加入蛋白酶抑制剂或者调节pH,但这些步骤简单易行。然而,如果第一步纯化样品步骤进行离子交换,样品则可能需要首先脱盐。当处理大量条件培养基时可能会有技术难度;根据培养基的脱盐体积常可采用透析或错流过滤。
如果靶蛋白在胞内表达,则细胞首先需要通过离心获取,然后用合适的裂解缓冲液重悬。如上所述,裂解缓冲液需要包含合适的缓冲液和其它添加剂以确保靶蛋白的最大稳定性。如果研究者在柱层析之前避免耗时的缓冲液交换步骤,则样品/裂解缓冲液的组成也需与随后的纯化步骤相适宜。
接下来,需要有效的细胞裂解方法。文献中已经描述了各种方法。大肠杆菌可以通过弗氏压碎器裂解(尽管这种方法不容易规模化),超声或基于洗涤剂的裂解(有很多商业裂解试剂)。通过向裂解缓冲液中加入溶菌酶可以改善基于洗涤剂的裂解效率。基于洗涤剂的裂解非常温和,且不导致细菌DNA的显着切变。因此,为了降低样品粘度产生具有良好流动特性的样品,通常需要加入含DNA酶 。
哺乳动物和昆虫细胞也可以通过超声或基于洗涤剂的方法裂解。如果核膜显着裂解,可能需要DNA酶处理降低样品粘度 。
一旦细胞(微生物/昆虫/哺乳动物)被裂解,通常需要离心除去细胞碎片(通常在4℃下15000×g离心15分钟,以避免色谱柱堵塞)。所得上清液即可开始用于靶蛋白的柱色谱层析纯化。
其它因素
蛋白质纯化工艺中的其他因素也会对蛋白质的稳定性产生影响。对蛋白质的处理步骤越少越好,在最短时间内采用最少步骤的纯化工艺才能保证得到最高产率的活性蛋白质。而且,在整个纯化过程中,蛋白质最好都保持在低温状态。一般纯化过程都在4°C进行,因为这个温度既可以降低酶解速度(在含有蛋白酶的情况下),又可以保证蛋白质的结构完整性。
1.开发及操作人员对上面内容的掌握能力,会影响工艺设计及操作过程。
2.过程中使用的设备及仪器的精准度,稳定性也会影响最终的结果。
3.过程所使用的试剂药品的质量也会引起结果的偏差。
4.环境因素除温度外,洁净程度也影响最终结果。
——注:此文内容部分整理自互联网!




