PCR优化体系,使你很快地获得PCR条件:
一、Tm值(MeltingTemperatures)&Ta值(AnnealingTemperatures退火温度)
你送出去设计引物的公司会在说明书上提供你的寡核苷酸引物的Tm,但是我们发现不同的公司根据他们采用的计算方式所提供的Tm明显不一样。我推荐IDTwebsite的引物设计工具OligoAnalyzer在优化退火温度方面非常好用~但是我觉得你还歹自己搞清楚其优化的原理,Tm计算公式如下:
Tm=2(A+T)+4(G+C)
其中A,T,G和C表示你的引物序列中对应的碱基数

Tm与缓冲液的盐浓度、pH值以及引物浓度有关,但是一般人很少去考虑这些。大部分人会告诉你,为了防止引物二聚体的形成,推荐你退火温度要比Tm值至少高到10℃。OligoAnalyzer工具在设计引物时也会考虑到模板DNA的二聚体结构。但是我建议退火温度设定值比你两个引物最低的Tm低3℃。例如,如果你的前置引物Tm是62℃,后置引物Tm是61℃,那么设定它们的退火温度为58℃。
如果你拥有一台具有梯度扩增功能的
PCR仪,同时具有足够量的模板,你可以进行两到三次的重复试验。我建议设定一定范围的退火温度进行实验,并评估每个温度效果。

(这里推荐大家使用本公司代理的雅睿PCR)
二、降落PCR(TouchdownPCR)
我最喜欢的一个技巧是降落PCR法,在前几循环的PCR反应中设置为较高的退火温度。在每一循环(或两个循环,或三个循环)之后,退火温度Ta降低1~2℃,这种方法本人屡试不爽。
那么,具体怎么做呢?使用上面的例子,两条引物的Tm值分别为62℃和61℃,我会设置退火温度Ta在前两个循环是63℃,接下来的两个循环是62℃,然后是61℃、60℃和59℃,共有10循环。然后在58℃温度下进行25个循环。这种技术好处是,前几个循环是非常严格的,所以它是不太可能发生任何非特异性扩增。同时,当退火温度变得更加容易结合引物时,PCR小管就像具有一定量目标扩增子的水库,当水库中已经具有足够量的目标扩增子时,目标扩增子即可在与非特异性序列的引物争夺中取得胜利!
以上实验的前提是确保你的PCR仪能够准确、有效地进行温度调整。我能理解在一个不能正常工作的PCR仪上会有多少时间被浪费在优化PCR条件,因为我吃过这样的苦头。一般来说,你的PCR仪工作不正常,你的PCR反应可能需要比平时花更长的时间。所以在你进行PCR反应时,要确保你的每一步都是能够工作的!包括你的机器、设置的条件以及反应条件、反应成分(即你以前验证过的引物、模板和缓冲条件)。
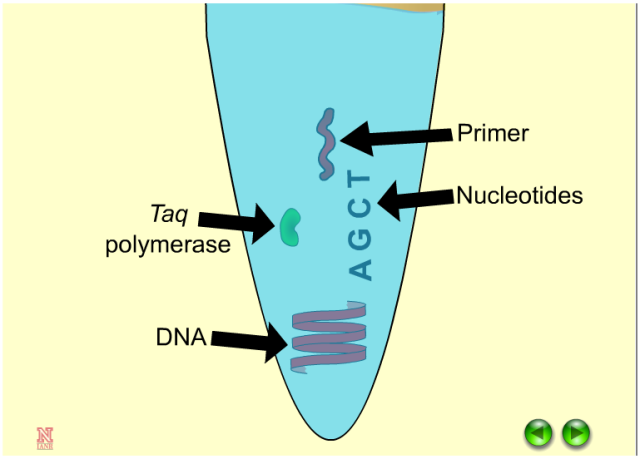
三、DNA模板
PCR需要的模板质量会很高!同时,过度的DNA模板含量有可能会降低反应的特异性,增加不必要产物的扩增。引物PCR反应是非常灵敏的,因此尽可能使用较低浓度的模板量。我们推荐的模板量:
质粒DNA模板不超过1ng;
cDNA:10-40ng;
基因组DNA:1μg。

(测定蛋白浓度有:NanodropND-2000,以及EppendorfBioPhotometerPlus。有些实验室资金有限,跑胶跟蛋白marker亮度比对也不失为一种办法~)
四、延伸时间
你曾经有没有想过到底是谁想出PCR反应的条件和方法,使得变性和退火时间一直以来都保持一致,只有延伸时间可根据你扩增大小进行调整。一般的经验法则是你每扩增1kb需要60秒的延伸时间(根据你选用的聚合酶的效率)。例如,如果你扩增一个2kb的片段,你需设计120秒的延伸时间。对于较短的产物,缩短延伸时间。对于一个200bp的扩增产物,15到20秒的延伸时间是足够的。延伸时间过长会引入不必要的非特异性的PCR产物!
五、聚合酶的选择
TaqDNA聚合酶在PCR反应中用的最多,尤其在验证目的基因的PCR扩增中。Pyrococcusfuriosus(PFU)聚合酶则广泛应用于高保真的PCR反应中。
但是也有一些其他的聚合酶对不同的模板有着不一样的扩增效率。比如:如果你的扩增模板中含有较高的GC含量(超过65%),ThermoScientific的AccuprimeG-CRichDNAPolymerase扩增的效果将会更好!而国产品牌例如巨匠生物ATG的Proofast™Super-FidelityDNAPolymerase在保真度和扩增速率上均有不俗表现,当你需要进行全质粒PCR时大大缩短了时间。Takara的PrimerSTARMaxDNAPolymerase被做成Mix,在保证高保真前提下方便使用!
(以上这些产品本人曾经亲自用过,本公众号原则上不打广告,以上厂家你们看着办~~哈哈~如果有好的产品可以留言告知!)
六、缓冲液组分
当你购买一管DNA聚合酶时,包装里会配备一管已经优化好的Buffer。正常来说,安装说明书进行操作是不会错的。但是我认为作为一个研究生,了解Buffer组分和浓度对PCR效率的影响很有必要。因为大部分Buffer只是简单地在某个pH值下进行盐离子(KCl和MgCl2)的混合。
七、镁离子
可以调整镁离子浓度来改变PCR的效率和保真度。对TaqDNApolymerase,优化的镁离子浓度是1.5到2mM,因为其他的缓冲液和反应所需的组分有可能会对镁离子产生螯合作用,从而需要增加镁离子浓度。最终在设定镁离子浓度时,会作一个小调整(大约增加0.5mM)
八、引物
需要花一整天来讨论的恐怕就是PCR引物的设计了,包括引物长度、GC含量、Tm值、二聚体等等……

在这里,我就简单地介绍优化引物浓度。如果添加过多的引物,会增加非特异性结合和引物二聚体。我经验,引物浓度推荐设定为1μM的较低水平效果会好很多。为了提高特异性,引物浓度甚至可以降到0.1μM,但是可能会减低PCR产量。
九、dNTPs
dNTPs的浓度不仅会影响PCR的特异性也会影响产量。太高浓度的dNTP将会降低特异性,太低有可能降低产量。然而对于我来说产量没有特异性重要,因此我在我的大部分PCR反应中用50μMdNTP浓度。你可以将dNTP浓度提高到200μM来提高产量。
HopefullythesetipswillgetyouthroughPCRoptimizationquicklyandpainlessly.