自从抗体被发现以来,有多种方法可以用于分离纯化抗体,全球的科学家们一直在探索有效的单抗分离纯化方法,以及适于抗体药物规模生产的工艺。本文对已经报道过单抗的分离纯化方法做以总结,为规模化抗体药物分离纯化工艺的提供选择策略。
1 单克隆抗体的纯化工艺
单克隆抗体的分离纯化工艺采用三步法纯化策略:捕获--中度纯化--精纯。根据捕获所选用的层析介质不同主要分两种类型:
A. 使用经典的Protein A为捕获步骤设计的纯化工艺。
B. 使用非Protein A 设计的纯化工艺。
现在在已经上市的抗体(包括Fc融合蛋白)药物,两种工艺均有采用。但是以Protein A为捕获工艺的产品约占70%。使用非protein A捕获的工艺约30%。随着抗体项目不断增多,抗体纯化工艺的平台工艺随之出现。抗体有类似的结构,所以使用平台工艺可以更好的了解工艺特性,产品质量等特性。为GMP认证中的工艺验证提供基础。更快的将产品推向市场。
2. 单抗分离纯化中的亲和层析介
亲和层析具有专一、高效的特性,使用亲和层析纯化后,抗体的纯度一般大于95%以上,收率在95%以上;所以在抗体纯化工艺中一般使用亲和层析作为单抗纯化工艺的捕获步骤。在单抗分离纯化中,按照不同的产品特性可以选择的亲和层析主要有:
A.嵌合抗体,人源化,全抗体一般使用Protein A 或
Protein G层析介质为捕获步骤;
B FC融蛋白一般使用Protein A层析介质做捕获步骤。
C Fab片段,或scFv 单链抗体一般使用ProteinL层析介质捕获, Protein L (Capto L)对轻链kappa片段有特异吸附。如果轻链的种类是Lambda,可以选择LambdaFabSelect层析介质特异的捕获。
D 单区域抗体sdAb一般有VH区域,也可以使用protein A,如MabSelect 作为捕获步骤。
3. Protein A层析介质
a Protein A 的性质
金黄色葡萄球菌A蛋白(Staphylococal ProteinA,SPA)是一种从金黄色葡萄球菌细胞壁分离的蛋白质,能特异性地与人或哺乳动物抗体(主要是IgG)的Fc区域结合。天然的protein A SPA由十种氨基酸组成。由于不含有胱氨酸及半胱氨酸,所以无二硫键。紫外光谱和吸收系数为A275nm和1.65,等电点为pH5.1。SPA十分稳定,4mol/L尿素、硫氰酸胍、6mol/L的盐酸胍和pH2.5的酸性条件以及加热煮沸均不影响其活性。分子量:全长的SPA54KD,去掉与细胞壁结合部分的SPA 42KD。SPA与IgG结合的亚类主要是IgG1、IgG2和IgG4,对IgG3没有吸附,不同的物种有一定的差异,可以参考GE公司《AntibodyPurification Handbook》。
SPA 分子有5个区域,分为E/D/A/B/C。抗体IgG有两个区域与SPA结合,分别是Fc与Fab区域。主要与Fc的CH2,CH3结合的是SPA的B区域;与Fab结合位点是VH3,SPA的结合位点是D和E区域2。对于不同的抗体轻链,Kappa轻链的结合力大于Lambda轻链。
近几年来基因工程的SPA出现,解决了天然protein A的耐碱性问题,MabSelectSure是基因工程的SPA,去掉了天然SPA的D/A/C/E区域,对于B区域进行了修饰,将不耐受NaOH的氨基酸去掉,或更换为耐受NaOH的氨基酸。使修饰后的SPA可以耐受0.1-0.5M的NaOH;这就很好的解决了层析介质CIP的问题,同时修饰后的SPA也耐受蛋白酶。使SPA的脱落更低。
b Protein A 层析介质的来源
1. 天然Protein A:使用CNBr方法与琼脂糖偶联;
2. 重组protein A:大肠杆菌表达,无动物成分来源,通过CNBr方法与琼脂糖偶联;
3. 重组protein A:大肠杆菌表达,通过稳定的硫醚键与琼脂糖偶联;
4. 重组protein A,大肠杆菌表达,无动物成分来源,通过还原的氨基与琼脂糖偶联,可以多点与IgG结合,吸附两个IgG分子;
5. 重组protein A,大肠杆菌表达,无动物成分来源,通过环氧键与高流速琼脂糖偶联;
6. 重组基因工程protein A,大肠杆菌表达,无动物成分来源。耐碱Protein A。通过环氧键与高流速琼脂糖偶联。LX为高载量。
4 Protein G的性质
Protein G是从G类Streptococci细菌中分离出来的胞壁蛋白,与多数哺乳动物的IgG Fc区域结合;天然的Protein G与血浆中的白蛋白有亲和力,所以通过基因工程重组的Protein G去掉了白蛋白的亲和位点。
Protein G可以抗体的不同亚型结合,IgG1、IgG2、IgG3、IgG4。与Ig G的Fc结合,同时也可以结合IgGCH1区域。所以在抗体片段的纯化中也可以使用Protein G纯化Fab片段。
Protein GSepharose 4 Fast Flow 使用重组的protein G,大肠杆菌表达,已经去除了白蛋白结合位点,此配基为 MW17KD。在全抗体或Fc融合蛋白的纯化中由于Protein A 层析介质的载量高于ProteinG,SPA的动态载量一般为20-60g/L。Protein G的动态载量一般为20-30g/L。所以在抗体的纯化工艺中一般使用Protein A层析介质。
5 Protein L的性质
Protein L 是上世纪80年代从Peptostreptococcusmagnus菌中分离得到的。天然的Protein L由719个氨基酸组成,不含二硫键,是一个酸性的分子PI为4。与IgG的轻链(L链)结合。Protein L主要与Kappa 轻链有亲和力。Protein L对不同的IgG,IgM,IgA,IgE以及IgD均有亲和力。Protein L结合轻链的Kappa区域,与lambda 没有亲和作用,亲和位点在轻链的I、III、IV区域。Capto L是大肠杆菌表达的基因工程Protein L为配基(分子量35KD)与Capto骨架偶联的Bioprocess 系列亲和介质。
在人免疫球蛋白轻链中包含两种亚型,Lambda和Kappa,大约60%的IgG 为kappa,40% 的IgG 含有Lambda。在建立纯化方法前,最好鉴定轻链的类型。选择正确层析介质分离纯化。
6 亲和层析技术的分离纯化策略
1 Protein A
层析介质的发展历史单抗作为同一类分子有其类似的分子结构,这是使用平台技术作为分离纯化的基础。例如:含有Fc片段的全抗体或Fc融合蛋白可以使用Protein A层析介质作为捕获步骤。
单抗药物的剂量为几毫克-几百毫克。由于单抗要求的剂量较大,如:Rituximab 400mg/m2,Humira 40mg/剂;所以单抗药物的产品质量要求极高。杂质的残留量极低,例如:HCP<100ppm,DNA<10pg/剂, Protein A<10ppm,聚体<1%。Protein A捕获步骤主要去除的杂质:大部分HCP,DNA;由于 ProteinA层析介质对聚体没有去除作用,所以在此捕获步骤中尽量减少聚体的形成,某些Protein A层析介质在纯化中会产生聚体,这样的protein
A介质尽量避免使用。在此捕获步骤中会有Protein A(配基)的脱落。在Protein A捕获过程中,培养上清中的蛋白酶会降解层析介质的配基Protein A,因此样品收集液中会有Protein A的片段;以及ProteinA与介质骨架的偶联方式不稳定,这些都是protein A的脱落原因。所以选择Protein A脱落较低的层析介质是非常关键的。
2 用于捕获抗体的Protein A层析介质的选择
现在商业化Protein A的层析介质较多,对于不同的项目选择方法如下:
A. Fc融合蛋白:一般Fc融合蛋白的DBC低于单抗。这是Fc融合蛋白的空间位阻效应大于单抗。对于Fc融合蛋白MabSelectXtra高动态载量的重组protein A介质是比较好的选择;
B. FC融合蛋白:如果Fc融合蛋白的稳定性差,由其在低pH缓冲液中,可以选择MabSelect Sure。由于只有FC区域的结合,所以洗脱时的所用的pH稍高;
C. 高表达量:随着细胞培养技术的改进,抗体的表达水平不断提高,对于高表达量的项目可以选择Mabselect Sure LX。通常的载量在60g/L以上;
D. 不同可变区的类型在Protein A层析介质的DBC也不同,一般VH3 > VH 1>VH2>VH4;
E. 修饰后的ProteinA 如:Mabselect Sure 对Fab没有亲和作用,此类介质不能用于抗体的结构域VH;
F. Fab,ScFv可以按照分子的结构中轻链类型选择Capto L,或LambdaFabSelect。
7 Protein A作为抗体的工艺的捕获选择策略:
A. 耐碱性
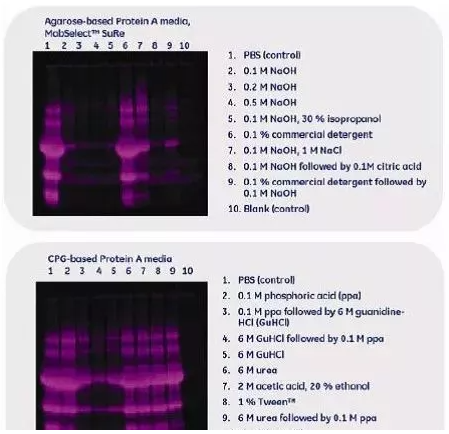
药物GMP生产最基本的要求是无菌、无热源。NaOH是最好的除菌、除热源的试剂。同时NaOH也是公认的CIP试剂,使用NaOH可以很好的除去残留在层析介质上的杂质,以确保工艺的稳定性以及层析介质的寿命;并且NaOH的成本低。NaOH是公认的CIP试剂,实验表明,NaOH的清洗效果高于其他试剂。如图,NaOH清洗Protein A层析介质的效果。如下图。
用不同CIP试剂清洗后凝胶颗粒上的残留蛋白。SDS-PAGE(DeepPurple染色)用于评估CIP试剂的清洗效率。NaOH是一种非常高效的清洗试剂,适合琼脂糖基架的填料。而对照的可控玻璃基架(CPG)填料的清洗结果表明,盐酸胍比磷酸更为有效。CPG填料在高pH下不稳定,不适合用NaOH清洗。
MabSelect Sure 系列是通过基因工程修饰的Protein A介质,提高了层析介质耐受NaOH的能力。修饰后的Protein A在洗脱时,不同的抗体洗脱pH更均一,为抗体纯化的平台工艺提供了基础。同时,MabSelect Sure LX是最新的Protein A层析介质,结合了耐碱和高载量的性质。
同时病毒的去除效率在Protein A的步骤中与层析介质有关,随着载量的下降以及柱压的升高,收率的降低,证明层析介质寿命到期,病毒的清除效率降低。
B. 动态载量与保留时间
一般ProteinA层析介质的理论载量为70-80g/L左右。高载量可以减少层析柱的体积。保留时间是指样品在层析柱内的停留时间或样品与层析介质的接触时间。较低的保留时间可以使用较快的流速,从而提高生产效率在抗体纯化工艺开发时,动态载量以及保留时间是一个平衡的过程,单纯追求高动态载量,可能保留时间会较长,使得上样时间延长,这样培养基中的蛋白酶就有时间分解样品,以及上样时蛋白酶降解Protein A,使Protein A的脱落增加。另外一些高载量的protein A 层析介质,是通过提高配基密度(ProteinA)增加动态载量的。但是配基密度提高过程中,如果配基与的层析基质(骨架)的偶联不稳定,就会增加protein A的脱落。此类ProteinA介质在初期动态载量较高,经过一段时间的使用,随着配基的脱落,载量很快降低。
单纯追求高流速,可能会使层析介质的柱压升高,提高了纯化过程中对生产设备(层析柱以及层析系统)的要求。随着上样次数的增多(生产循环次数的增加)层析介质的反压增高,从而减少层析介质的寿命。另外,有文献报道,以硅胶基质或CPG的层析介质在重复装柱的过程中易破碎,从而增加运行的压力以及减少介质的使用寿命。现代的Protein A的动态载量一般在35-60g/L之间,保留时间一般在3-5min左右(20cm柱床高度,线性流速在250-400cm/h)。
随着细胞培养条件的改善,抗体的表达量的提高(由原来的1-2g/L提高到5g/L以上),对于Protein A层析介质的关注从上样的速度转到关注上样的载量(DBC)。事实上,现在普遍更关注的要点是DBC与上样的速度的平衡。
C. 低配基脱落
配基脱落在单抗药物中有严格的规定,在最终的药物中protein A 的残留<10ppm。所以Protein A捕获步骤中,选择低protein A的脱落的层析介质对抗体药物质量控制以及工艺的风险控制是非常关键的。
Mabselect 系列的Protein A层析介质的protein A的proteinA残留在20ppm以下。采用环氧键与高流速琼脂糖偶联,增加了偶联稳定性,从而降低了Protein A的脱落。同时,配基脱落高,也会导致介质的寿命缩短。层析介质的寿命是需要几十至上百次试验的结果证明,有些介质可能在小试时30-50个循环后,载量、收率以及产质量的结果可以接受,但是随着使用次数的增加,配基脱落显著,从而造成纯度收率下降。
D. 低非特异杂质吸附
Protein A捕获的样品是细胞培养的上清液。宿主蛋白是捕获步骤的中主要杂质。虽然ProteinA对抗体的Fc有特异性、专一性,但是层析介质的基质(骨架)有时会对杂质有非特异吸附。有文献报道以聚合物为基质的ProteinA层析介质非特异吸附较高,洗脱时宿主蛋白会与抗体共同洗脱。从而HCP的残留量较高。以琼脂糖为基质ProteinA层析介质非特异吸附较低,一般的洗脱收集的样品中HCP的残留在100-200ppm 之间10。捕获步骤中的低HCP会减少精细纯化步骤的压力。
E. 层析介质的工业装柱方法
在生产中,层析介质与层析柱是配合使用的;所以层析介质的装柱是一项必不可少的工作。在抗体的中试与生产中使用的层析柱一般直径在300mm以上;有些剂量大的项目,生产中需要使用直径1-1.4m的层析柱,因此,生产规模的层析柱--装柱简易性是非常关键的。由于生产规模使用的层析介质体积较大,所以在层析柱的设计时采用几种装柱模式:
1.采用泵将层析介质喷入层析柱中,例如ChromaFlow;
2. 采用吸入的方式,将层析介质吸入层析柱中,例如Axichrom。
层析柱的装柱不只是层析柱的设计,层析介质的装柱方法是否适用,以及在装柱过程中层析介质是否易破碎也是抗体工艺选择层析介质关键的因素。例如:CPG为骨架的层析介质在装柱中需要不断震荡,以及装柱及拆柱过程中易碎。这可能会造成生产的潜在风险。
在规模化生产中,装柱结果的重复性和层析柱的稳定性也是非常关键的因素。在考虑层析介质性能的同时还要考虑层析介质是否适于GMP生产以及供应商的稳定供货。GMP要求:
1. 层析介质的生产过程中没有使用动物源成分;
2. 层析介质的稳定性,包括不同pH下,温度等,例如:ProteinA在低pH洗脱,层析介质在低pH的稳定性,配基脱落、骨架的泄露等。
3. 层析介质的批间差异,生产规模的层析介质要求批间差异小。
4.层析介质的批量,即一批层析介质的产量,一般一根层析柱装同一批次的层析介质用于工业生产。
5. 法规支持文件,完备的法规支持文件可以方便药品报批过程中工艺验证。
8 总结
2012年,Oxford Analytica通过实验,验证了Mabselect Sure可以减少15%的生产成本。它为抗体仿制药提供了一个简单,稳定,高效的工具。提高新一代抗体的生产能力、在生产过程中的稳定性以及产品的稳定性是现代抗体工艺的研发趋势。选择稳定的亲和层析介质作为起始捕获步骤,可以得到最佳的生产工艺。