服务热线
13751863457
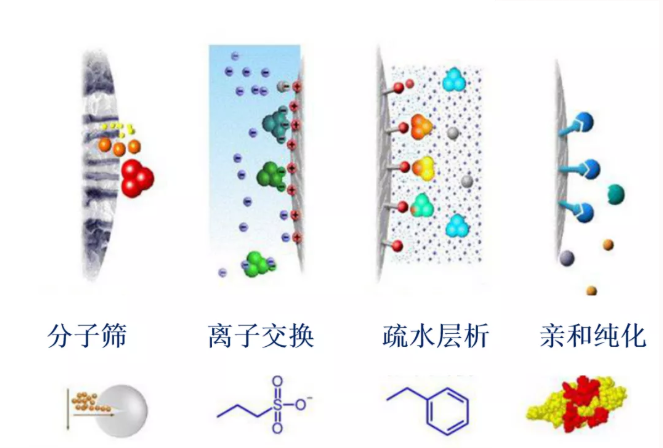
| 层析方法 | 亲和纯化色谱 | 离子交换色谱 | 凝胶过滤色谱 | 疏水作用色谱 |
| 分离机制 | 特异性 | 所带电荷 | 分子大小 | 疏水性 |
| 载量 | 高 | 高 | 低 | 高 |
| 纯化速度 | 高 | 高 | 中等 | 高 |
| 生物相容性 | 好 | 好 | 非常好 | 中等 |
| 目的蛋白得率 | 高 | 高 | 高 | 中等 |
| 问题 | 解决方案 |
| 纯化的蛋白/抗体错误 | 检查DNA,确认序列是否正确 |
|
洗脱的蛋白/抗体有污染需要提高纯度
|
结合和洗涤条件应更加严格结合和洗涤缓冲液中应含有最高浓度可为20 mM的咪唑
色谱柱太大一减少树脂用量
与标签蛋白相关的污染加入B-ME等还原剂以减少二硫鍵形成
|
| 蛋白/抗体沉淀 |
增加其他纯化步骤,如离子交换色谱
维持低浓度(浓度<1 mg/mL)
维持充分的还原状态(>5 mM DTT),以免氧化
维持高盐浓度(500 mM)并加入甘油(>10%) 加入精氨酸,浓度为50 mM-500 mM
加入温和的非变性去污剂,如0.1%6B-辛基葡糖苷
|
| 洗涤步骤中蛋白/抗体洗脱 |
在温下纯化
降低洗涤缓中液中咪唑浓度
|
| 蛋白/抗体洗税不下来 |
降低洗涤缓冲液的严格度
洗脱条件可能太温和一使用梯度pH值和洗脱缓冲液洗脱,以确定最佳洗脱条件
蛋白可能处于聚集(寡聚体/多聚俐)状态-在变性条件下洗脱
蛋白在色谱柱中沉淀--分批结合井洗脱,以免局部蛋白浓度过高
|
上一篇:生物安全柜和超净台的认证知识
下一篇:蛋白的提取纯化程序
Copyright © 2002-2020 广州倍肯生物科技有限公司 版权所有 备案号:粤ICP备17050916号-1
倍肯生物优秀的实验室仪器供应商,厂价供应:洁净工作台、实时荧光定量pcr仪、电泳仪、生物安全柜等,为实验室提供完美的仪器采购方案。
地址:广州市天河区大观中路492号广东岭南职业技术学院28栋慧创百思创业园B228 电话:13751863457 邮箱:beikenshengwu@qq.com

添加微信好友咨询
